نقدم لكم ملخص درس المحاليل المنظمة لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني
يلخص هذا الملف مفهوم المحاليل المنظمة وتأثيرها في الكيمياء للصف الثاني عشر، مع التركيز على أهمية الكواشف ومنحنيات الرقم الهيدروجيني (pH) في معايرات الأحماض والقواعد.
رابط تنزيل ملخص درس المحاليل المنظمة لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني
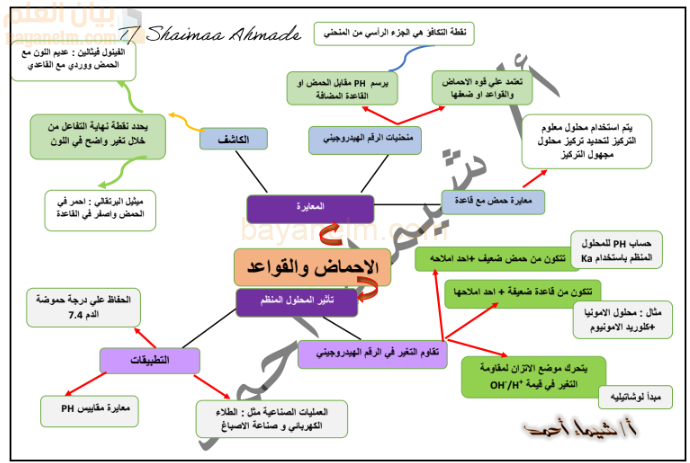
المحلول المنظم:هو محلول كيميائي يقاوم التغير في الرقم الهيدروجيني (pH) عند إضافة كميات قليلة من حمض قوي أو قاعدة قوية. يعتمد مبدأ عمله على مبدأ لوشاتيليه، حيث يتحرك موضع الاتزان لمقاومة التغير في تركيز أيونات الهيدروجين أو الهيدروكسيد. تتكون المحاليل المنظمة من:
- حمض ضعيف وأحد أملاحه (مثال: حمض الإيثانويك وخلات الصوديوم).
- قاعدة ضعيفة وأحد أملاحها (مثال: محلول الأمونيا وكلوريد الأمونيوم).تطبيقات المحاليل المنظمة: تشمل الحفاظ على درجة حموضة الدم (pH 7.4)، واستخدامها في العمليات الصناعية مثل الطلاء الكهربائي وصناعة الأصباغ، بالإضافة إلى معايرة مقاييس pH.
المعايرة:هي عملية مخبرية تستخدم لتحديد تركيز محلول مجهول التركيز باستخدام محلول معلوم التركيز.الكاشف:مادة كيميائية تستخدم لتحديد نقطة نهاية التفاعل عن طريق تغير واضح في اللون. أمثلة:
- الفينولفثالين: عديم اللون مع الحمض ووردي مع القاعدي.
- الميثيل البرتقالي: أحمر في الحمض وأصفر في القاعدة.
منحنيات الرقم الهيدروجيني (pH):هي رسوم بيانية توضح تغير pH مقابل حجم الحمض أو القاعدة المضافة. يمثل الجزء الرأسي من المنحنى “نقطة التكافؤ”. وتعتمد أشكال هذه المنحنيات على قوة الأحماض والقواعد المتفاعلة.أنواع المعايرات ومنحنياتها:
- حمض قوي + قاعدة قوية:
- نقطة التكافؤ عند pH = 7.
- منحنى انحدار حاد جدًا (من pH 2 إلى 12).
- كاشف مناسب: البروموثايمول الأزرق (يتغير لونه بين 6.0 – 7.6).
- حمض قوي + قاعدة ضعيفة (مثل الأمونيا وحمض الهيدروكلوريك):
- نقطة التكافؤ عند pH = 5 (في المنطقة الحمضية).
- منحنى انحدار حاد (من pH 1.7 إلى 8).
- كاشف مناسب: الميثيل الأحمر (يتغير لونه بين 4.2 – 6.3).
- قاعدة قوية + حمض ضعيف (مثل حمض الإيثانويك وهيدروكسيد الصوديوم):
- نقطة التكافؤ عند pH = 9 (في المنطقة القاعدية).
- منحنى انحدار حاد (من pH 6 إلى 12).
- كاشف مناسب: الفينولفثالين (يتغير لونه بين 8.2 – 10).
- قاعدة ضعيفة + حمض ضعيف (مثل الأمونيا وحمض الإيثانويك):
- لا يوجد انحدار حاد في المنحنى، وبالتالي لا يوجد كاشف حمض-قاعدة مناسب لتحديد نقطة النهاية لهذا التفاعل.







