نقدم لكم ملخص السلسلة المتجانسة للاحماض الكربوسيلية لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني
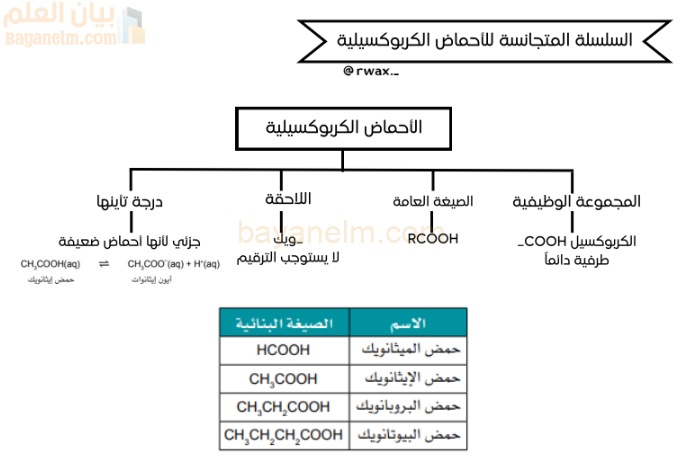
تُعد الأحماض الكربوكسيلية سلسلة متجانسة من المركبات العضوية التي تتميز بوجود المجموعة الوظيفية الكربوكسيل (COOH) التي تكون دائمًا طرفية. صيغتها العامة هي RCOOH، حيث تشير R إلى مجموعة ألكيل. تُسمى هذه الأحماض بإضافة اللاحقة “ويك” إلى اسم الألكان المقابل، ولا يستوجب ترقيم المجموعة الوظيفية لوجودها في نهاية السلسلة الكربونية. من الأمثلة الشائعة على هذه الأحماض: حمض الميثانويك (HCOOH)، حمض الإيثانويك (CH₃COOH)، حمض البروبانويك (CH₃CH₂COOH)، وحمض البيوتانويك (CH₃CH₂CH₂COOH).
رابط تنزيل ملخص السلسلة المتجانسة للاحماض الكربوسيلية لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني
تُظهر الأحماض الكربوكسيلية مجموعة من التفاعلات الكيميائية المميزة نظرًا لطبيعتها الحمضية. تتفاعل هذه الأحماض مع القواعد في تفاعل تعادل، حيث ينتج عنها ملح وماء. على سبيل المثال، يتفاعل حمض الإيثانويك مع هيدروكسيد الصوديوم لينتج إيثانوات الصوديوم والماء.
كما تتفاعل الأحماض الكربوكسيلية مع الفلزات النشطة في تفاعل أكسدة-اختزال، حيث ينتج عن هذا التفاعل ملح وغاز الهيدروجين. مثال على ذلك هو تفاعل حمض الإيثانويك مع المغنيسيوم، والذي ينتج إيثانوات المغنيسيوم وغاز الهيدروجين.
بالإضافة إلى ذلك، تتفاعل الأحماض الكربوكسيلية مع الكربونات في تفاعل حمض-قاعدة، لينتج عن ذلك ملح وماء وغاز ثاني أكسيد الكربون. يظهر ذلك بوضوح في تفاعل حمض الإيثانويك مع كربونات البوتاسيوم، الذي ينتج إيثانوات البوتاسيوم والماء وثاني أكسيد الكربون.
تجدر الإشارة إلى أن الأحماض الكربوكسيلية، مثل حمض الإيثانويك، هي أحماض ضعيفة، مما يعني أن درجة تأينها في المحاليل المائية تكون جزئية. فعندما يتأين حمض الإيثانويك في الماء، فإنه يتفكك جزئيًا إلى أيون الإيثانوات وأيون الهيدروجين، ويكون التفاعل في حالة اتزان. هذا التأين الجزئي هو السمة الأساسية التي تميز الأحماض الضعيفة عن الأحماض القوية.







