ملخص منظم وجميل لحسابات الرقم الهيدروجيني للاحماض القوية والقواعد القوية لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول

نقدم لكم ملخص منظم وجميل لحسابات الرقم الهيدروجيني للاحماض القوية والقواعد القوية لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول
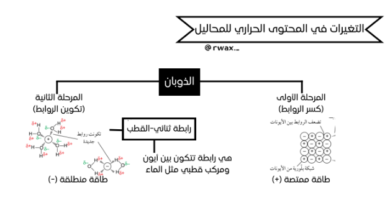
تُعد الوحدة الأولى في منهاج الكيمياء للصف الثاني عشر بوابةً أساسية لفهم سلوك المواد في المحاليل المائية، مع تركيز خاص على الأحماض والقواعد. تبدأ هذه الوحدة بتقديم مقياس الرقم الهيدروجيني (pH) كأداة حيوية لتمييز المحاليل، حيث تدل القيم الأقل من سبعة على الحمضية، والأكبر من سبعة على القاعدية، بينما تشير القيمة سبعة إلى التعادل.
رابط تنزيل ملخص منظم وجميل لحسابات الرقم الهيدروجيني للاحماض القوية والقواعد القوية لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول
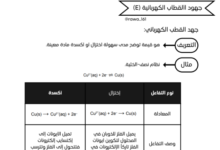
تُقدم الوحدة نظرية أرهينيوس التي تفسر سلوك الأحماض والقواعد بناءً على تأينها في الماء، فالأحماض تنتج أيونات الهيدروجين، والقواعد تنتج أيونات الهيدروكسيد. هذه النظرية تميز بين الإلكتروليتات القوية التي تتأين كليًا، والإلكتروليتات الضعيفة التي تتأين جزئيًا، مما يمهد لفهم الفروقات الجوهرية في قوة الأحماض والقواعد.
تنتقل الوحدة بعد ذلك إلى نظرية برونستد-لوري، التي توسع هذا المفهوم لتشمل انتقال البروتونات. فالحمض هو المادة المانحة للبروتون، والقاعدة هي المستقبلة له. هذا المنظور يُدخلنا إلى مفهوم الزوج المترافق، حيث تتشكل القاعدة المرافقة من الحمض بعد منح البروتون، والحمض المرافق من القاعدة بعد استقبال البروتون. كما تُسلط الضوء على الدور المزدوج للماء كمادة متذبذبة، قادرة على التصرف كحمض وقاعدة على حد سواء.
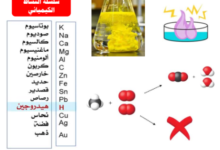
يُعد التمييز بين الأحماض والقواعد القوية والضعيفة محورًا أساسيًا في الوحدة. فالأحماض والقواعد القوية تتأين بشكل كامل في المحلول المائي، مما يؤدي إلى تركيزات مرتفعة من أيونات الهيدروجين أو الهيدروكسيد. من الأمثلة البارزة على الأحماض القوية حمض الهيدروكلوريك وحمض الكبريتيك، بينما هيدروكسيد الصوديوم مثال على القواعد القوية. في المقابل، تتأين الأحماض والقواعد الضعيفة جزئيًا فقط، مما يعني وجود توازن بين الجزيئات غير المتأينة والأيونات الناتجة، وينتج عن ذلك تركيزات منخفضة من هذه الأيونات. حمض الإيثانويك والأمونيا أمثلة على الأحماض والقواعد الضعيفة على التوالي.
تختتم الوحدة بمناقشة ثابت تأين الماء، الذي يربط بين تركيز أيونات الهيدروجين والهيدروكسيد في أي محلول مائي. هذا الثابت، إلى جانب مفاهيم مثل الرقم الهيدروجيني والرقم الهيدروكسيلي، يُعد أساسًا للحسابات المتعلقة بحمضية وقاعدية المحاليل. تُشدد الوحدة على أن قوة الحمض أو القاعدة تتعلق بدرجة تأينها، وليس بتركيزها، وهو تمييز مهم لفهم السلوك الكيميائي لهذه المواد.