ملخص ملاحظات على منحنيات المعايرة لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني
نقدم لكم ملخص ملاحظات على منحنيات المعايرة لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني
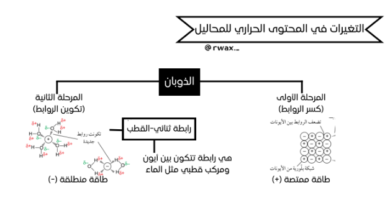
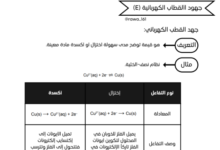
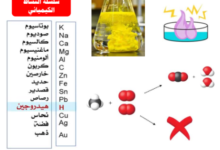
يشرح الملف كيفية تحديد نقطة نهاية وبداية منحنيات المعايرة، مع الأخذ في الاعتبار نوع الحمض أو القاعدة (قوي/ضعيف، أحادي/ثنائي البروتون) وكونه في السحاحة أو الدورق.
رابط تنزيل ملخص ملاحظات على منحنيات المعايرة لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني
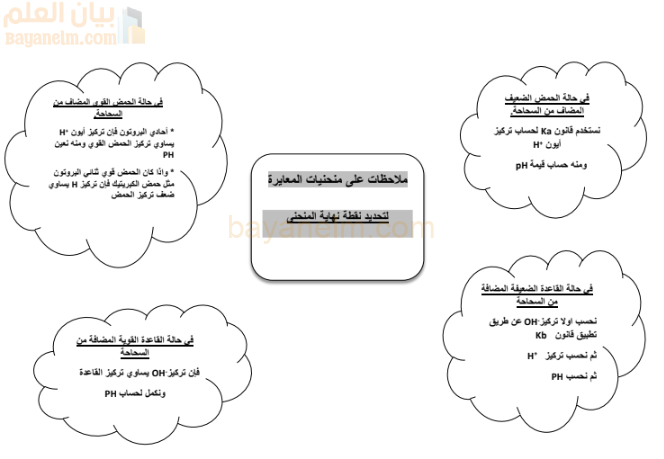
لتحديد نقطة نهاية المنحنى (المادة المضافة من السحاحة):
- الحمض القوي (أحادي البروتون): تركيز أيون الهيدروجين يساوي تركيز الحمض، ومنه يُحسب الرقم الهيدروجيني (pH).
- الحمض القوي (ثنائي البروتون مثل حمض الكبريتيك): تركيز أيون الهيدروجين يساوي ضعف تركيز الحمض، ومنه يُحسب pH.
- القاعدة القوية: تركيز أيون الهيدروكسيد يساوي تركيز القاعدة، ومنه يُحسب pH.
- الحمض الضعيف: يُحسب تركيز أيون الهيدروجين باستخدام قانون ثابت تأين الحمض (Ka)، ثم يُحسب pH.
- القاعدة الضعيفة: تُحسب أولاً تركيز أيون الهيدروكسيد باستخدام قانون ثابت تأين القاعدة (Kb)، ثم يُحسب تركيز أيون الهيدروجين (باستخدام العلاقة بين [H⁺] و [OH⁻])، وأخيرًا يُحسب pH.
لتحديد نقطة بداية المنحنى (المادة الموجودة في الدورق):
- الحمض الضعيف: يُحسب pH بمعلومية قيمة Ka أو باستخدام العلاقة بين تركيز أيون الهيدروجين وتركيز أيون الهيدروكسيد عند ظروف معينة.
- القاعدة الضعيفة: يُحسب pOH بمعلومية قيمة Kb، ثم يُحسب pH، أو باستخدام العلاقة بين تركيز أيون الهيدروجين وتركيز أيون الهيدروكسيد عند ظروف معينة.
- الحمض القوي (أحادي البروتون): تركيز أيون الهيدروجين يساوي تركيز الحمض القوي، ومنه يُحسب pH.
- الحمض القوي (ثنائي البروتون مثل حمض الكبريتيك): تركيز أيون الهيدروجين يساوي ضعف تركيز الحمض، ومنه يُحسب pH.
- القاعدة القوية: تركيز أيون الهيدروكسيد يساوي تركيز القاعدة، ومنه يُحسب pH.
تُشير الملاحظات إلى أن نقطة بداية المنحنى دائمًا هي قيمة pH على محور الصادات، وتعبر عن نوع المحلول الموجود في الدورق.
Visited 12 times, 1 visit(s) today