ملخص درس معايرة الاحماض والقواعد لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني

نقدم لكم ملخص درس معايرة الاحماض والقواعد لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني
يلخص هذا الملف دروس معايرة الأحماض والقواعد لمادة الكيمياء للصف الثاني عشر .
رابط تنزيل ملخص درس معايرة الاحماض والقواعد لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني
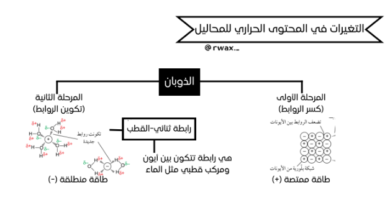
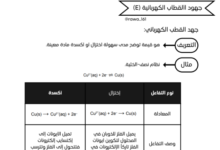
يُعرّف الملف المعايرة بأنها إجراء مخبري يستخدم لتحديد التركيز غير المعلوم لمحلول حمضي أو قاعدي، وذلك باستخدام محلول قياسي (معلوم التركيز). ويشير إلى أن المحلول القياسي هو محلول ذو تركيز معلوم يُقاس حجمه بدقة باستخدام السحاحة.تتطرق الوثيقة إلى ثلاثة أنواع رئيسية من المعايرات، موضحة كيفية تغير قيم pH لكل نوع:
- معايرة قاعدة قوية مع حمض قوي: في هذا النوع، تكون نقطة التكافؤ عند pH = 7. يتميز منحنى المعايرة بانحدار حاد بين pH = 2 و pH = 12. يمكن استخدام كواشف مثل البروموثايمول الأزرق (يتغير لونه بين 6 و 7.6) أو الفينولفثالين (يتغير لونه بين 8.2 و 10)، نظرًا لوجود مدى واسع للتغير الحاد في pH.
- معايرة قاعدة ضعيفة مع حمض قوي: هنا، تقع نقطة التكافؤ في المنطقة الحمضية (أقل من 7، على سبيل المثال عند pH حوالي 5.5). يظهر منحنى المعايرة انحدارًا حادًا بين pH = 1.7 و pH = 8. يوضح الملف أن كاشف الميثيل الأحمر (الذي يتغير لونه بين pH = 4.2 و pH = 6.3) مناسب لهذه المعايرة، بينما الفينولفثالين غير مناسب لأن مدى تغير لونه لا يتوافق مع المنطقة الحادة.
- معايرة قاعدة قوية مع حمض ضعيف: في هذا النوع، تقع نقطة التكافؤ في المنطقة القاعدية (أكبر من 7، على سبيل المثال عند pH حوالي 9). يظهر منحنى المعايرة انحدارًا حادًا بين pH = 6 و pH = 12. يشير الملف إلى أن كاشف الفينولفثالين مناسب لهذه المعايرة، بينما الميثيل البرتقالي غير مناسب لأن لونه يتغير في المناطق الحمضية التي لا تتوافق مع هذا التغير الحاد ل pH في هذه المعايرة.
أخيرًا، يُعرّف الملف منحنى pH للمعايرة بأنه تمثيل بياني لتغير pH مقابل حجم الحمض أو القاعدة المضافة، ويؤكد أن شكل المنحنى يختلف باختلاف قوة كل من الحمض والقاعدة المستخدمين.
Visited 24 times, 2 visit(s) today