ملخص درس تفاعلات تحضير الكحولات لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني
نقدم لكم ملخص درس تفاعلات تحضير الكحولات لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني
يلخص هذا الملف طرق تحضير الكحولات، مع التركيز على التفاعلات الكيميائية والعوامل الحفازة المستخدمة. [1]1. اختزال الأحماض الكربوكسيلية: [1]
- النوع: تفاعل اختزال. [1]
- المعادلة العامة: حمض كربوكسيلي يتحول إلى كحول وماء بوجود عامل مختزل. [1]
- مثال: حمض الإيثانويك يتحول إلى إيثانول وماء. [1]
رابط تنزيل ملخص درس تفاعلات تحضير الكحولات لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول المنهج العماني
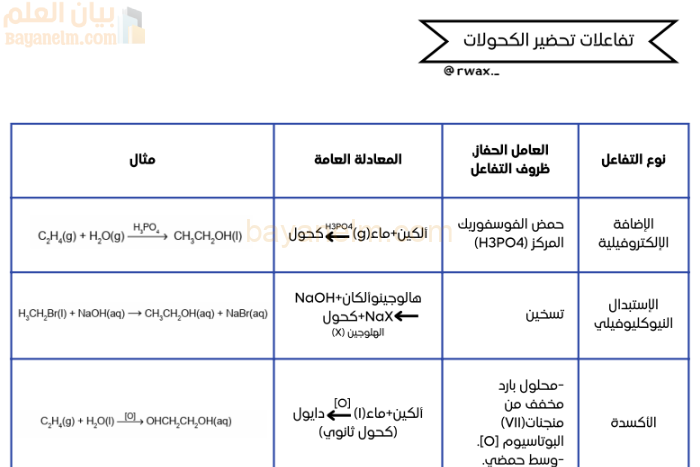
2. الإضافة الإلكتروفيلية للألكينات: [1]
- النوع: إضافة إلكتروفيلية. [1]
- المعادلة العامة: ألكين يتفاعل مع الماء لإنتاج كحول. [1]
- العامل الحفاز: حمض الفوسفوريك المركز (H3PO4). [1]
- مثال: الإيثين يتفاعل مع الماء لإنتاج الإيثانول. [1]
3. الإستبدال النيوكليوفيلي (هالوجينو ألكان): [1]
- النوع: استبدال نيوكليوفيلي. [1]
- المعادلة العامة: هالوجينو ألكان يتفاعل مع هيدروكسيد الصوديوم (NaOH) لإنتاج كحول وملح هالوجين الصوديوم. [1]
- مثال: برومو إيثان يتفاعل مع هيدروكسيد الصوديوم لإنتاج إيثانول وبروميد الصوديوم. [1]
4. الأكسدة (تحضير 1،2-دايول): [1]
- النوع: أكسدة. [1]
- المعادلة العامة: ألكين يتفاعل مع الماء بوجود عامل مؤكسد لإنتاج 1،2-دايول (كحول ثانوي). [1]
- العامل الحفاز وظروف التفاعل: تسخين، محلول بارد مخفف من برمنجنات البوتاسيوم (VII)، ووسط حمضي. [1]
- مثال: الإيثين يتفاعل مع الماء لإنتاج إيثان-1،2-دايول. [1]
5. التحلل المائي للإستر: [1]
- النوع: تحلل مائي. [1]
- المعادلة العامة: إستر يتفاعل مع الماء بوجود حمض مخفف لإنتاج حمض كربوكسيلي وكحول. [1]
- ظروف التفاعل: تسخين مع حمض مخفف. [1]
- مثال: إيثانوات الميثيل تتحلل مائيًا لإنتاج حمض الإيثانويك والميثانول. [1]
- ملاحظة: يمكن أن يتم التحلل المائي للإستر أيضًا بوجود قاعدة مخففة (NaOH) لإنتاج ملح الحمض الكربوكسيلي وكحول. [1]
6. اختزال الألدهيدات والكيتونات: [1]
- النوع: اختزال. [1]
- الألدهيدات: تختزل الألدهيدات لإنتاج كحولات أولية. [1]
- العامل المختزل: رباعي هيدريدوبورات الصوديوم (NaBH4) أو رباعي هيدريد ألومينات الليثيوم (LiAlH4) في إيثر جاف. [1]
- مثال: الإيثانال يختزل إلى إيثانول. [1]
- الكيتونات: تختزل الكيتونات لإنتاج كحولات ثانوية. [1]
- العامل المختزل: رباعي هيدريد ألومينات الليثيوم (LiAlH4) في إيثر جاف. [1]
- مثال: البروبانون يختزل إلى 2-بروبانول. [1]
ملاحظة هامة: يجب أن يكون المذيب العضوي المستخدم مع رباعي هيدريد ألومينات الليثيوم (LiAlH4) منزوع الماء تمامًا (جاف) [5]، لأن رباعي هيدريد ألومينات الليثيوم عامل مختزل قوي [6] ويتفاعل بشدة مع الماء. [7]
Visited 36 times, 1 visit(s) today