عرض تقديمي لشرح درس ثابت تأين الاحماض الضعيفة والقواعد الضعيفة لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول

نقدم لكم عرض تقديمي لشرح درس ثابت تأين الاحماض الضعيفة والقواعد الضعيفة لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول
يتناول هذا الملف مفهوم ثابت تأين الأحماض الضعيفة (Ka) والقواعد الضعيفة (Kb)، ويوضح كيفية استخدامهما في الحسابات المتعلقة بقوة الأحماض والقواعد في المحاليل المائية.
رابط تنزيل عرض تقديمي لشرح درس ثابت تأين الاحماض الضعيفة والقواعد الضعيفة لمادة الكيمياء للصف الثاني عشر الفصل الدراسي الاول
- فهم المفاهيم الأساسية لثابت تأين الحمض (Ka) وثابت تأين القاعدة (Kb)، والعلاقة التي تربط بينهما وبين ثابت تأين الماء (Kw).
- القدرة على كتابة معادلات الاتزان الخاصة بثوابت التأين لكل من الأحماض والقواعد الضعيفة بطريقة صحيحة.
- تحليل دلالات القيم العددية لـ Ka وKb، ومعرفة كيف تؤثر هذه القيم في قوة الحمض أو القاعدة ومدى تأينهما في الماء.
- إدراك أهمية استخدام قيمة pKa بدلاً من Ka في بعض الأحيان، وفهم العلاقة الرياضية التي تربط بينهما.
- اكتساب مهارة الحسابات الكيميائية المتعلقة بثوابت التأين، مثل حساب Ka للأحماض الضعيفة وKb للقواعد الضعيفة، بالإضافة إلى حساب قيمة pH للمحاليل المختلفة سواء كانت لأحماض أو قواعد قوية وضعيفة.
- التمييز بين الفرضيات المستخدمة في الحسابات، مثل إهمال تأثير تأين الماء في المحاليل الضعيفة نظرًا لضآلته.
ملخص المفاهيم الأساسية
- ثابت تأين الحمض الضعيف (Ka):
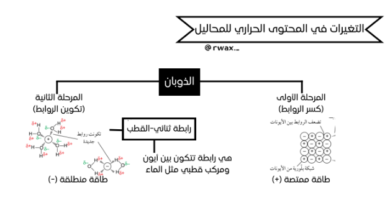
هو ثابت الاتزان الذي يعبّر عن درجة تأين الحمض الضعيف في الماء. كلما كانت قيمة Ka أكبر، كان الحمض أقوى وأكثر قدرة على منح أيونات الهيدروجين، والعكس صحيح. إذا كانت قيمة Ka صغيرة، فهذا يدل على أن التفاعل يميل إلى المتفاعلات، وأن الحمض يتأين بنسبة قليلة.
كما يُستخدم أحيانًا pKa (اللوغاريتم السالب لـ Ka) للتعبير عن قوة الحمض بطريقة أبسط؛ فكلما زادت قيمة pKa، قلت قوة الحمض. - حساب Ka لحمض ضعيف:
يتم الحساب بمعرفة تركيز الحمض وقيمة pH للمحلول. وعند إجراء الحسابات، يُهمل تأين الماء لأن تأثيره ضئيل جدًا مقارنة بتأين الحمض، كما يُفترض أن التأين جزئي بحيث يبقى تركيز الحمض غير المتأين قريبًا من تركيزه الابتدائي. - ثابت تأين القاعدة الضعيفة (Kb):
هو ثابت الاتزان لتفاعل القاعدة الضعيفة مع الماء لتكوين أيونات الهيدروكسيد. يُعد مقياسًا لقوة القاعدة، فكلما زادت قيمة Kb، كانت القاعدة أقوى وارتفعت قيمة pH للمحلول الناتج. - حساب Kb لقاعدة ضعيفة:
يُحسب بناءً على تركيز القاعدة وقيمة pH للمحلول، مع إهمال تأثير تأين الماء، وافتراض أن التأين محدود بحيث لا يُغيّر كثيرًا في التركيز الأصلي للقاعدة. - العلاقة بين Ka وKb وKw:
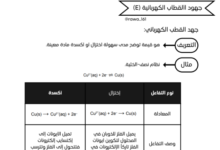
تربط بين هذه الثوابت علاقة مهمة:
Ka × Kb = Kw
أي أن حاصل ضرب ثابت تأين الحمض في ثابت تأين قاعدته المرافقة يساوي ثابت تأين الماء، الذي له قيمة ثابتة عند درجة حرارة معينة.
تُستخدم هذه العلاقة لحساب أحد الثوابت إذا كانت القيم الأخرى معلومة، وهي من أهم العلاقات في فهم طبيعة الاتزان بين الأحماض والقواعد في الكيمياء.
بهذا الفهم المتكامل، يستطيع الطالب أن يربط بين الجانب النظري للحموضة والقلوية وبين التطبيق العملي في حسابات pH وثوابت التأين، مما يُعزز قدرته على تحليل سلوك المحاليل المختلفة في السياقات الكيميائية المتنوعة.
Visited 17 times, 1 visit(s) today